עצה 1: כיצד להעביר אלקטרונים
עצה 1: כיצד להעביר אלקטרונים
אלקטרון הוא חלקיק בסיסי יציב נושאת מטען שלילי. גודל מטען האלקטרון נלקח כיחידה למדידת המטען החשמלי של חלקיקים בסיסיים.
הוראות
1
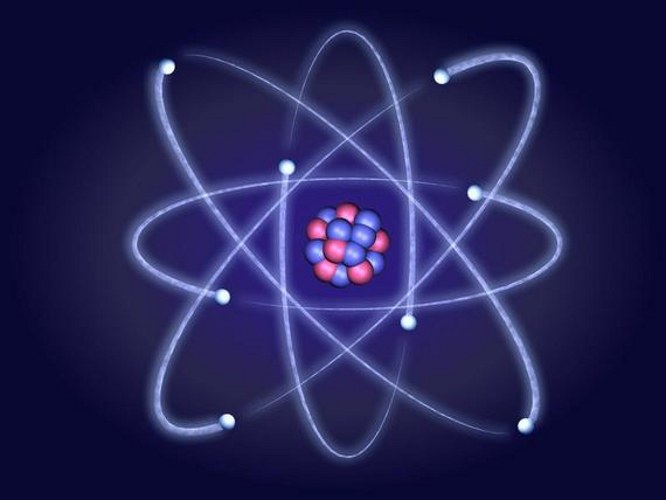
אלקטרונים נמצאים בתנועה מתמדת,מסתובבת סביב גרעין אטומי חיובי. סכום החיובים השליליים של האלקטרונים שווה לסכום החיובים החיוביים של הפרוטונים של הגרעין, כך שהאטום הוא נייטרלי. תנועת האלקטרונים סביב הגרעין אינה כאוטית, הסדירות שלה מתוארת על ידי התיאוריה הפלנטרית של מבנה האטום.
2
המודל הפלנטרי של האטום הוצע בהתחלההפיזיקאי הבריטי בן המאה העשרים רתרפורד. פשטני, על התאוריה של אטום Rutherford דומה למערכת כוכבים שבו כדור הארץ-האלקטרונים לנוע במסלולים מובהקים סביב הכוכב-האטום.
3
שימוש בחוקי המכניקה כדי לתאר את התנועהאלקטרון, כנקודה, הוא בלתי אפשרי. האלקטרון אינו זז במהירות המחושבת לאורך מסלול נתון, אך עם מחזוריות מסוימת מופיע באזור סיבובו סביב גרעין האטום. אזור כזה אינו מסלול ליניארי, אלא מסלול שקיים על פי חוקי מכניקת הקוונטים. אורביטלים אינטראקציה של כל האלקטרונים ליצור פגז אלקטרונים סביב הגרעין האטומי.
4
קליפת האלקטרון של האטום אינה הומוגנית, בתוכורמות אנרגיה עם כוח משיכה שונה של אלקטרונים לגרעין באים לידי ביטוי. בשכבות הקרובות לגרעין, האלקטרונים נמשכים לגרעין חזק יותר מאשר בשכבות הרחוקות יותר. ככל שהגרעין קרוב יותר, האלקטרונים הקטנים יותר במסלולים. המספר המרבי האפשרי של אלקטרונים ברמת האנרגיה N ניתן על ידי הנוסחה: N = 2n² כאשר n הוא מספר רמת האנרגיה.
5
אורביטלים יש צורות שונות. לכן, הענן האלקטרוני של הרמה הראשונה יש את הצורה היציבה ביותר - כדורית. שכבות רחוקות יותר הן דמויי משקולת, ומסלולים היקפיים יש תצורה מורכבת מאוד. רמות כאלה אינן יציבות מאוד, האלקטרונים נעים יחד עם מהירות הולכת וגוברת, הקשר עם הגרעין הופך חלש יותר, ואת האנרגיה של האלקטרונים מצטבר.
עצה 2: כיצד למצוא את מספר האלקטרונים באטום
האטום מורכב מגרעין ומהסובבים אותו אלקטרוניםאשר סובבים סביבו אטומיתאורביטלים וצורות אלקטרוניות (רמות אנרגיה). מספר החלקיקים טעונים שלילי ברמה החיצונית והפנימית קובע את המאפיינים של האלמנטים. מספר אלקטרוניםבתוך אטום, ניתן למצוא בידיעה כמה נקודות מפתח.
יהיה עליך
- - נייר;
- - הידית;
- מערכת תקופתית של מנדלייב.
הוראות
1
כדי לקבוע את מספר אלקטרונים, להשתמש במערכת תקופתית ד. אוניברסיטת מנדלייב. בטבלה זו, אלמנטים מסודרים ברצף מסוים, אשר קשורה קשר הדוק המבנה האטומי שלהם. בידיעה כי החיוב חיובי של האטום הוא תמיד שווה למספר הסוד של האלמנט, תוכלו למצוא בקלות את מספר החלקיקים השליליים. אחרי הכל, אנו יודעים כי האטום בכללותו הוא ניטרלי, כלומר המספר אלקטרונים יהיה שווה למספר הפרוטונים ומספר האלמנט שבטבלה. לדוגמה, מספר ההזמנה של אלומיניום הוא 13. כתוצאה מכך, מספר אלקטרונים הוא יהיה 13, 11 עבור נתרן, 26 עבור ברזל, וכן הלאה.
2
אם אתה צריך למצוא את הכמות אלקטרונים על רמות האנרגיה, חזור על הראשוןעקרון פול ואת הכלל Hund. לאחר מכן להפיץ את החלקיקים השליליים על פני רמות ו sublevels באמצעות מערכת תקופתיים אותו, או ליתר דיוק את תקופות וקבוצות. אז מספר הסדרה האופקית (נקודה) מציין את מספר שכבות האנרגיה, ואת אנכי (קבוצה) - על ידי המספר אלקטרונים ברמה החיצונית.
3
אל תשכח כי מספר חיצוני אלקטרונים שווה למספר הקבוצה של האלמנטים בלבדהם נמצאים בתת-קבוצות עיקריות. אלמנטים של תת-קבוצות של מספר חלקיקים טעונים שלילי ברמת האנרגיה הסופית לא יכול להיות יותר משני. לדוגמה, סקנדיום (Sc), הממוקם בתקופה 4, בקבוצה 3, תת מקריים של 2. בעוד גליום (Ga), אשר נמצא באותה התקופה באותה קבוצה, אבל בתת העיקרי חיצוני אלקטרונים 3.
4
בעת חישוב אלקטרונים ב אטום, שים לב כי הטופס השני מולקולות. במקרה זה, אטומים יכולים לקחת, לתת את החלקיקים טעונים שלילי או טופס זוג משותף. לדוגמה, במולקולה מימן (H2), הצמד הכולל אלקטרונים. מקרה נוסף: ב מולקולת הנתרן פלואוריד (NaF), את הסכום הכולל אלקטרונים יהיה שווה ל 20. אבל במהלך התגובה הכימית, אטום הנתרן נותן את האלקטרון שלה יש 10, ופלואורין לוקח - 10 מתקבל גם.







