טיפ 1: מהו המבנה הכימי
טיפ 1: מהו המבנה הכימי
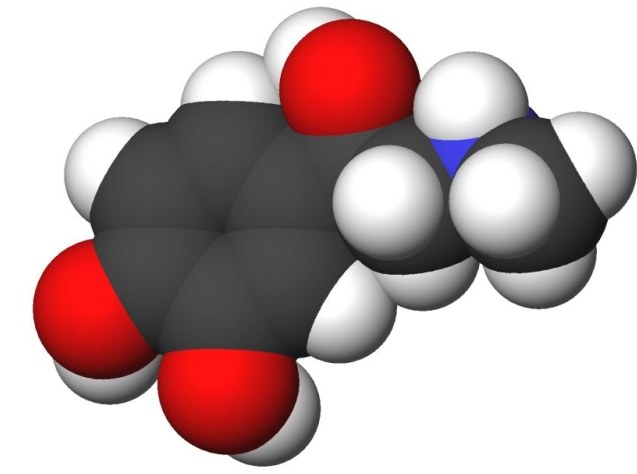
התיאוריה של המבנה הכימי היא תיאוריהמתאר את הסדר שבו האטומים מסודרים במולקולות של חומרים אורגניים, איזה השפעה הדדית האטומים מפעילים זה על זה, וגם מה תכונות כימיות ופיסיקליות של החומר לזרום מתוך הסדר הזה והשפעה הדדית.
טיפ 2: מה הם מספרים ראשוניים יחסית?
מספרים ראשוניים הדדית הם מושג מתמטי, כי לא צריך להיות מבולבל עם מספרים פשוטים. המשותף בין שני המושגים הוא רק שלשניהם יש קשר ישיר לחטיבה.

פשוט במתמטיקה נקרא מספר,אשר ניתן לחלק רק אחד על ידי עצמו. 3, 7, 11, 143 ואפילו 1 111 111 הם כולם מספרים ראשוניים, כל אחד מהם יש את זה בנפרד.כדי לדבר על מספרים ראשוניים הדדית, חייב להיות לפחות שניים מהם. מושג זה מאפיין את התכונה המשותפת של מספר מספרים.
הגדרת מספרים ראשוניים יחסית
פשוט הדדית אלה מספרים אלהאין מחלק משותף, לא סופר 1, למשל, 3 ו 5. במקרה זה, כל מספר בנפרד לא יכול להיות פשוט כשלעצמו.לדוגמה, מספר 8 כזה אינו חל, כי זה יכול להיות מחולק 2 ו 4, אבל 8 ו 11 הם מספרים ראשוניים יחסית. המאפיין המגדיר כאן הוא דווקא היעדר מחלק משותף, ולא המאפיינים של מספרים בודדים, אולם שני מספרים ראשוניים או יותר יהיו תמיד ראשוניים. אם כל אחד מהם מחולק לאחת ולתוכו בלבד, אז לא יכול להיות מחלק משותף, עבור מספרים ראשוניים הדדית יש סימון מיוחד בצורת קטע אופקי וניצב על גבי זה. זה בקורלציה עם המאפיין של קווים ישרים אנכיים, אשר אין להם כיוון משותף, כמו מספרים אלה אין מחלק משותף.Pairwise מספרים ראשוניים הדדית
אולי שילוב של מספרים ראשוניים יחסית,שממנו ניתן באופן אקראי לקחת כל שני מספרים, והם יהיו בהכרח פשוט הדדית. לדוגמה, 2, 3 ו -5: למחלק המשותף אין 2 ו -3, ולא 2 ו -5, ולא 5 ו -3. מספרים אלה נקראים 'זוגיות יחסית', אך לא תמיד מספרים ראשוניים הדדיים זה לזה. לדוגמה, המספרים 15, 20 ו - 21 הם מספרים ראשוניים הדדית, אבל הם לא יכולים להיקרא pairwise יחסית הממשלה, כי 15 ו - 20 מחולקים על ידי 5, ו 15 ו - 21 מחולקים על ידי 3.היישום של מספרים ראשוניים הדדית
בהעברת שרשרת, ככלל, את הכמותשרשרת קישורים שיניים להביס באים לידי ביטוי על ידי מספרים ראשוניים הדדית. עקב כך, כל אחת מהשיניים נוגעת בכל קישור של הרשת בתורו, המנגנון לובש פחות, יש תכונה מעניינת עוד יותר של מספרים ראשוניים הדדית. יש צורך לצייר מלבן שאורכו ורוחבו באים לידי ביטוי על ידי מספרים ראשוניים הדדית, ולצייר קרן מן הזווית בתוך המלבן בזווית של 45 מעלות. בנקודת המגע של הקרן עם הצד של המלבן, יש לצייר קרן אחרת, הממוקמת בזווית של 90 מעלות עד הראשונה, השתקפות. ביצוע כזה rays של השתקפות פעם אחר פעם, אתה יכול לקבל דפוס גיאומטרי שבו כל חלק של המבנה דומה לכל. מנקודת המבט של המתמטיקה, דפוס זה הוא פרקטל.עצה 3: מהי מערכת העיכול האנושית
אדם צריך לחיותחומרים מזינים: חלבונים, חומצות אמינו, מונוסכרידים וכדומה. כל זה באוכל, אבל בצורה מורכבת, קטנה לעיכול. על מנת התאים לקבל את החומרים שהם צריכים, המזון חייב להיות מפוצל. משימה זו מבוצעת על ידי מערכת העיכול את המערכת.

טיפ 4: מהו גז אינרטי
גזים אינרטיים בטבלה המחזורית הם אלמנטיםתת הקבוצה העיקרית של הקבוצה השמינית: הליום, ניאון, ארגון, קריפטון, קסנון ורדון, שהינו מרכיב רדיואקטיבי. הם נקראים גם גזים אצילים.

מבנה אלקטרוני של גזים אינרטיים
כל גזים אינרטי יש להשלים, יציבאת התצורה של רמה אלקטרונית חיצונית: הליום הוא דופלט, גזים הנותרים יש octet. כל אחד מהם משלים את התקופה המקבילה בטבלה המחזורית.גזים אינרטיים בטבע
כל גזים אינרטיים, למעט ראדון רדיואקטיבי,ניתן למצוא את האוויר האטמוספרי. הליום הוא המרכיב הנפוץ ביותר בחלל לאחר מימן. השמש היא 10% מורכב זה גז אצילי, נוצר מימן על ידי התגובה של היתוך גרעיני עם שחרור של פוזיטרונים antineutrinos.תכונות פיסיקליות של גזים אצילים
גזים אינרטי מיוצגים על ידי monatomicמולקולות. בתנאים רגילים, הליום, ניאון, ארגון, קריפטון ו קסנון - גזים ללא צבע וריח, מסיסים בצורה גרועה במים. ככל שמספרם האטומי גבוה יותר, כך גבוה יותר נקודת ההרתחה ונקודת ההתכה, הליום בעל תכונות ייחודיות: הוא נשאר נוזלי אפילו בטמפרטורות הנמוכות ביותר, עד אפס מוחלט, ללא התגבשות. התגבשות הליום אפשרית רק בלחץ של 25 אטמוספרות. בנוסף, גז זה יש נקודת הרתיחה הנמוכה ביותר של כל החומרים.תכונות כימיות של גזים אצילים
במשך זמן רב הוא האמין כי גזים אינרטי בכלללא יוצרים חיבורים. עם זאת, באופן ניסיוני בתנאים מיוחדים, פלואורידים ותחמוצות קסנון הושגו, אשר קיומה של ניבא על ידי התיאורטיקן לינוס פאולינג.כיצד להשתמש בגזים אינרטיים
הודות שלו פיסיקלי כימי מצטייניםמאפיינים של גזים אצילים נמצאים בשימוש נרחב בתחומי מדע והנדסה. לפיכך, עם הליום נוזלי המיוצר טמפרטורה נמוכה מאוד, ואת תערובת של הליום וחמצן ביחס של 4: 1 משמש הליום vodolazov.Poskolku אווירת נשימה מלאכותי - גז הקלה לאחר מימן, הם לעתים קרובות מלאים ספינות אוויר, בלונים ו בדיקות. כוח הרמה שלה שווה 93% של המעלית vodoroda.Neon, ארגון, קריפטון קסנון משמש טכנולוגיית תאורה - לייצור צינורות פריקים בגז. כאשר הזרם חשמלי מועבר דרך הצינור מלא ניאון או גז ארגון מתחיל לזהור, והצבע של האור הזה תלוי בלחץ gaza.Argon כמו היקר ביותר של גזי אצילים משמש ליצירת אווירה אינרטי במהלך תגובות כימיות שמוצריה אינטראקציה עם חמצן.עצה 5: מהו מסלול אטומי
כל חומר בטבע מורכב הקטן ביותרחלקיקים, אטומים הנקראים. הממדים שלהם כל כך קטנים, כי בעצם חלקיקים אלה מעולם לא נראו, נתונים על המבנה שלהם ואת המאפיינים מבוססים על ניסויים רבים באמצעות מגוון רחב של מכשירים מורכבים.
מבנה האטום
האטום מורכב משני חלקים עיקריים: הליבה ואת פגז אלקטרונים. בתורו, הגרעין הוא שילוב של פרוטונים ונייטרונים, אשר נקראים יחד נוקלאונים; פגז האלקטרונים של הגרעין מורכב רק אלקטרונים. לגרעין יש מטען חיובי, המעטפה שלילית, ויחד הם יוצרים אטום נייטרלי מבחינה חשמלית.היסטוריה
כפי שנאמר קודם לכן, האטום מורכב מגרעין ואלקטרונים נעים סביבו. לעתים קרובות, כדי לפשט את הציורים סכמטי של אטומים, מאמינים כי האלקטרונים לסובב במסלולים מעגליים, כמו כוכבי הלכת של מערכת השמש סביב השמש. מודל חי זה הוצע בשנת 1911 על ידי הפיזיקאי האנגלי המצטיין ארנסט ראת'רפורד. עם זאת, לא ניתן היה להוכיח זאת באופן ניסיוני, והמונח "מסלול" נטש בהדרגה. כבר בתחילת שנות השלושים של המאה העשרים נקבע לבסוף כי לאלקטרון באטום אין מסלול ברור של תנועה. זה היה אז כי בעבודותיו של הפיזיקאי האמריקאי רוברט מוליקן והפיזיקאי הגרמני מקס בורן, הופיע מונח חדש - מסלולית - עיצור ומסלול משמעות קרוב.ענן אלקטרוני
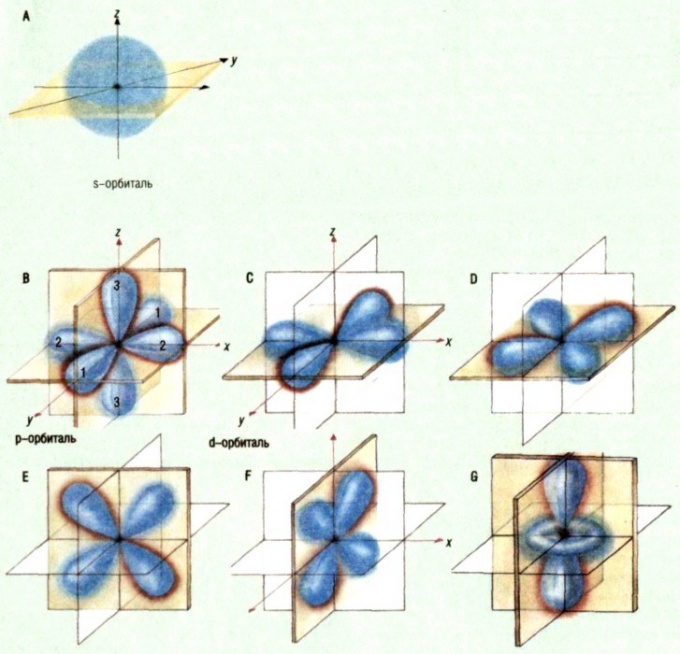
הענן האלקטרוני הוא מערך שלם של נקודות,שבו אלקטרון נסע לתקופה מסוימת של זמן. אזור זה של ענן האלקטרון, שבו האלקטרון הופיע לעתים קרובות יותר, הוא המסלול. לרוב, מתן הגדרה של מונח זה, אומרים שזה המקום של האטום, שבו המיקום של האלקטרון הוא הסיכוי הטוב ביותר. המילה "כנראה" משחקת תפקיד מפתח כאן. באופן עקרוני, האלקטרון יכול להיות בכל חלק של האטום, אך ההסתברות למצוא אותו מחוץ לאיזור האורביטלים היא קטנה ביותר, לכן יש להניח כי האורביטלי הוא כ -90% מענן האלקטרון. מבחינה גרפית, המסלול מתואר בצורת משטח המציין את האזור שבו הופעתו של האלקטרון היא ככל הנראה. לדוגמה, עבור אטום של מימן, מסלולית יש צורה כדורית.סוגי אורביטלים
כיום, מדענים מגדירים חמישה סוגיםאורביטלים: s, p, d, f ו- g. הצורות שלהם חושבו על ידי שיטות של כימיה קוונטית. אורביטלים קיימים בלי קשר לשאלה אם האלקטרון נמצא בהם או לא, בעוד שלאטום של כל אלמנט, הידוע כיום, יש סט שלם של כל האורביטלים, וכימיה המודרנית היא אחד המושגים המגדירים המאפשרים לחקור את תהליכי היווצרות הקשרים הכימיים.המועצה 6: מהו הערכיות
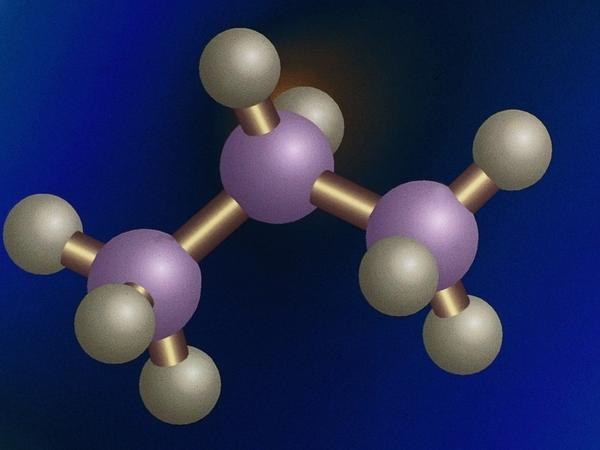
Valence - אחד התנאים העיקריים המשמשיםהתיאוריה של המבנה הכימי. מושג זה קובע את היכולת של אטום ליצור קשרים כימיים מייצג כמותי את מספר החיבורים בהם הוא משתתף.
הוראות
1
Valence (מן הלטינית. Valentia - "כוח") הוא אינדיקציה ליכולת של אטום לצרף לעצמה אטומים אחרים, ויוצרים איתם קשרים כימיים בתוך מולקולה. סך כל האג"ח שבהן אטום יכול להשתתף שווה למספר האלקטרונים הלא-מזויפים שלו. אג"ח כאלה נקראים קשרים קוולנטיים.
2
אלקטרונים לא מכוונים הם אלקטרונים חופשייםהחיצוני של האטום, אשר מחוברים עם אלקטרונים חיצוניים של אטום אחר. כל זוג כזה נקרא אלקטרון, ואלקטרונים כאלה הם ערכיות. מתוך כך, ההגדרה של הערכיות עשויה להישמע כך: זהו מספר זוגות האלקטרון שעליו אטום נתון קשור לאטומים אחרים.
3
Valence האטום מתואר באופן סכמטי בנוסחאות כימיות מבניות. אם מידע זה אינו נחוץ, אז את הנוסחאות הפשוטות ביותר משמשים, שבו valence לא צוין.
4
הערכיות המקסימלית של כימיקליםאלמנטים של קבוצה אחת של המערכת התקופתית, ככלל, שווה למספר הסידורי של הקבוצה. בתרכובות כימיות שונות, אטומים של אלמנט אחד יכול להיות valances שונים. הקוטביות של הקשרים קוולנטיים שהתקבלו לא נלקח בחשבון, ולכן הערכיות אין סימן. זה לא יכול להיות אפס או שלילי.
5
המדד הכמותי של כל יסוד כימינהוג לשקול את מספר אטומי המימן החד-חמצני או אטומי החמצן הדו-חמצני. עם זאת, בקביעת הערכיות, ניתן להשתמש גם באלמנטים אחרים שערכם ידוע.
6
לעתים מזוהה עם המושג "שוויון"את המונח "מידת החמצון", אבל זה לא נכון, אם כי במקרים מסוימים האינדיקטורים האלה זהים. דרגת החמצון היא מונח רשמי, כלומר מטען אפשרי שאטום יקבל אם האלקטרונים שלו בזוגות אלקטרונים יועברו לאטומים חשמליים יותר. במקרה זה, מידת החמצון באה לידי ביטוי ביחידות של מטען, ועלול להיות סימן, בניגוד לערכיות. מונח זה הפך נפוץ בכימיה אנאורגנית, שכן קשה לשפוט את הערכיות של תרכובות אנאורגניות. Valence הוא משמש גם כימיה אורגנית, שכן רוב תרכובות אורגניות יש מבנה מולקולרי.
עצה 7: מהו קשר יוני?
מליטה יונית הוא אחד הזניםקשר כימי, המתעוררת בין יונים טעונים מנוגדים של אלמנטים אלקטרו-אקוסטיביים ואלקטרו- היונים, כידוע, הם חלקיקים הנושאים מטען חיובי או שלילי, אשר נוצרים מאטומים על רתיעה או התקשרות של אלקטרונים.
עצה 8: מה זה ציטופלסמה?
ציטופלסמה הוא מרכיב סלולרי חשוב מאוד. בסביבה הפנימית נוזלי למחצה שלה הם האברונים אחראי על הפונקציות החיוניות של התא. הניידות של הציטופלסמה מקדמת את האינטראקציה של האברונים זה עם זה. זה מאפשר את הופעתה של תהליכים של מטבוליזם תאיים.






